Ο καρκίνος του ενδομητρίου αποτελεί, μετά τον καρκίνο του μαστού, τον συχνότερα εμφανιζόμενο γυναικολογικό καρκίνο στις αναπτυγμένες χώρες. Υπολογίζεται πως έχουμε 142.000 νέες περιπτώσεις κάθε έτος σε ολόκληρο τον κόσμο.
Μέχρι και τον Σεπτέμβριο του 2022 η κατάταξη για τα καρκινώματα του ενδομητρίου γινόταν σε 2 τύπους βάσει των κλινικών, μεταβολικών και ενδοκρινικών χαρακτηριστικών τους. Ο τύπος Ι περιλαμβάνει τα grade 1-2 ενδομητριοειδή, ενώ ο τύπος ΙΙ τα grade 3 ενδομητριοειδή και τα μη ενδομητριοειδή νεοπλάσματα (ορώδες, διαυγοκυτταρικό, μεικτού τύπου κλπ).
Πλέον, η νέα μοριακή ταξινόμηση κατά FIGO κατανέμει τα καρκινώματα του ενδομητρίου σε 4 προγνωστικές κατηγορίες:
1. Ultramutated (PΟLEmut),
2. Hypermutated/mismatch repair deficient (MΜRd),
3. Copy-number high με μεταλλάξεις του ΤP53 (p53abn) και
4. Copy-number low χωρίς κάποια συγκεκριμένη μετάλλαξη (ΝSMP) .
Τα POLEmut νεοπλάσματα έχουν την καλύτερη πρόγνωση με 98% πιθανότητα να μην υποτροπιάσουν εντός 5-ετίας. Τα NSMP και MMRd καρκινώματα του ενδομητρίου έχουν κατά 74% και 72% πιθανότητες 5 έτη ελεύθερα υποτροπής αντίστοιχα, ενώ το ανάλογο ποσοστό στα p53abn μειώνεται στο 48%
Οι διεθνείς κατευθυντήριες οδηγίες συμπεριλαμβάνουν πλέον κατά την κατηγοριοποίησή τη νέα μοριακή ταξινόμηση, εφόσον αυτή είναι διαθέσιμη (Πίνακας 1). Σύμφωνα με αυτές, τα POLEmut νεοπλάσματα σταδίου Ι-ΙΙ χωρίς υπολειμματική νόσο, ενδομητριοειδή και μη, θεωρούνται πλέον χαμηλού κινδύνου αποκλιμακώνοντας τους θεραπευτικούς χειρισμούς σε γυναίκες που ως τώρα θεωρούνταν μετρίου-υψηλού (στάδιο ΙΙ) ή και υψηλού κινδύνου (μη ενδομητριοειδή νεοπλάσματα).

Ο μοριακός έλεγχος συνιστάται πλέον σε όλα τα νεοδιαγνωσθέντα καρκινώματα του ενδομητρίου καθώς δύναται να αλλάξει την ταξινόμησή τους και καθοδηγεί τους θεραπευτικούς χειρισμούς.
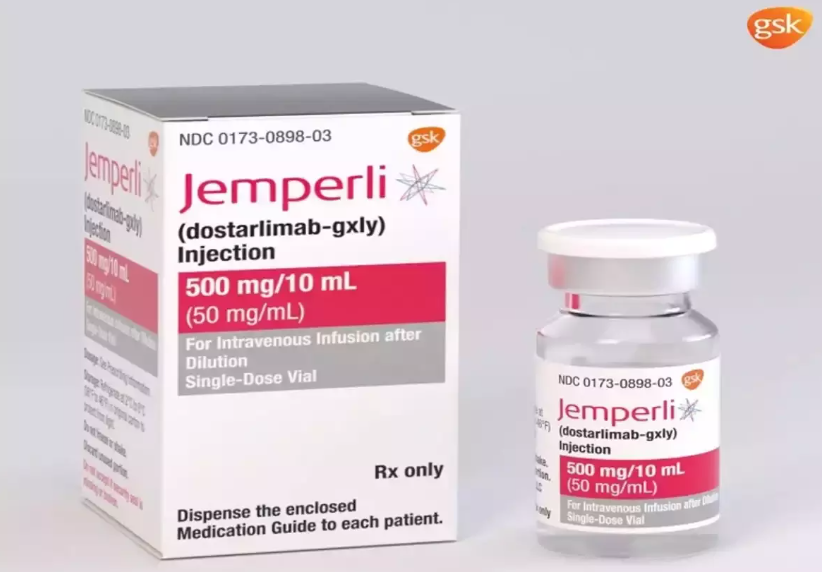
Ο συνδυασμός του μοριακού ελέγχου με την ανάπτυξη νέων φαρμάκων ανοίγει την παλέτα της χημειοθεραπευτικής αντιμετώπισης και πέραν της 1ης γραμμής. ‘Ετσι η anti-PD1 ανοσοθεραπεία με pembrolizumab ή dorstalimab μπορεί να χρησιμοποιηθεί σε MSΙ/MΜRd καρκινώματα ως δεύτερη γραμμή θεραπείας ενώ ο συνδυασμός του pembrolizumab με τον αναστολέα τυροσινικής κινάσης lenvatinib μπορεί να χρησιμοποιηθεί σαν δεύτερη γραμμή θεραπείας σε καρκινώματα χωρίς μικροδορυφορική αστάθεια .
Τέλος, στα ορώδη νεοπλάσματα του ενδομητρίου ελέγχεται και ο HΕR2 υποδοχέας, που μέχρι πρότινος είχε θεραπευτική αξία μόνο στον καρκίνο του μαστού. Στα HΕR2 θετικά νεοπλάσματα η χρήση του trastuzumab σε συνδυασμό με χημειοθεραπεία (paclitaxel and carboplatin) έχει δείξει βελτίωση του διάμεσου χρόνου χωρίς πρόοδο νόσου.
Συμπερασμετικά, με τη νέα μοριακή ταξινόμηση των καρκινωμάτων του ενδομητρίου η αντιμετώπιση των ασθενών γίνεται ακόμα πιο εξειδικευμένη και στοχευμένη και αποσκοπεί στη βελτίωση της επιβίωσης των ασθενών αυτών.
Κοτανίδης Χρήστος MD, MSc
Διευθυντής Τμήματος Γυναικολογικής Ογκολογίας ΙΑΣΩ Θεσσαλίας
τ. Αν. Διευθυντής Γυναικολογικής Ογκολογίας Humboldt Clinic Berlin